Velocidad de reacción del NaIO3 con NaHSO3
Se va a estudiar la velocidad de reacción a temperatura constante entre el trioxoyodato de disodio y el hidrógenotrioxosulfato (IV) de sodio (bisulfito de sodio).
La reacción produce yodo que, para una determinada concentración, hace virar a violeta el almidón utilizado como indicador.Cronometrar el tiempo que tarda el viraje permite comprobar el aumento de la velocidad de reacción al aumentar la concentración del trioxoyodato manteniendo constante la del bisulfito.
Enlace al guión de laboratorio.




Material
- Gradilla y 8 tubos de ensayo |
.
El hidrógenotrioxosulfato (IV) de sodio (bisulfito de sodio) parece haberse dejado de comercializar en favor del
Na2S2O5 (que comercialmente se denomina metabisulfito sódico). |
Comentarios a la preparación del montaje
Si se utiliza Na2S2O5, hay que tener en cuenta que, al disolverse en agua, se disocia
según la siguiente reacción:
Na2S2O5 + H2O → 2 Na+ + 2 HSO3-
Por tanto, se debe calcular una concentración 0,025M de Na2S2O5 para obtener una
concentración 0,05M de NaHSO3.
Conciene que esta disolución sea reciente, pues parece degradarse con el tiempo.
Al volcar un tubo en otro, la mezcla es imperfecta ya que la estrechez del tubo de ensayo la impide.
Es conveniente utilizar tubos de ensayos grandes, en los que la mezcla es mejor.
Aspectos didácticos
Este trabajo pretende:
- Preparar disoluciones de varias concentraciones molares por dilución.
- Medir la dependencia de la concentración una cinética química.
- Utilizar el viraje de un indicador como referencia del final de una reacción.
- Utilizar las gráficas concentración-tiempo para comprobar el comportamiento de la velocidad de reacción con la concentración.
La preparación de las disoluciones es simple, ya que son compuestos que se comercializan puros.
Sin embargo, la dilución y el cálculo de la concentración en cada cado suele dar bastantes problemas.
Poner tres pipetas por grupo permite usar una para cada disolución y otra para el agua. Si no las mezclan, es la forma de
que no contaminen unas disoluciones con otras. Esta organzación y que las disoluciones son muy diluidas y de productos
de baja peligrosidad, favorece que se ponga a tres alumnos por equipo a pipetear.
Tendrá lugar la siguiente reacción:
10 NaHSO3 + 4 KIO3 → 2 I2 + 5 Na2SO4 + 2 K2SO4 + 3 H2SO4 + 2 H2O
Como se puede ver, es una reacción redox de cierta complejidad. Sería difícil de ajustar incluso para alumnado de química (II), debido a la bimolecularidad del yodo.
En la reacción se libera I
Para el debate posterior sobre la gráfica [KIO3] (mol/l) frenta al tiempo (s):
- ¿Puede la curva cortar al eje vertical? Eso implicaría un tiempo de reacción nulo, que es imposible.
- ¿Puede la curva cortar el eje horizontal? Eso implicaría un tiempo de reacción para una concentración nula de KIO3.
Hay que considerar que es implosible una reacción en ausencia de un reactivo. Por tanto, la gráfica ha de ser asintótica en ambos ejes.
 Antes de la reacción. |
 Antes de la reacción. |
 Inicio del viraje. |
 Inicio del viraje. |
 Viraje completo. |
 Viraje completo. |
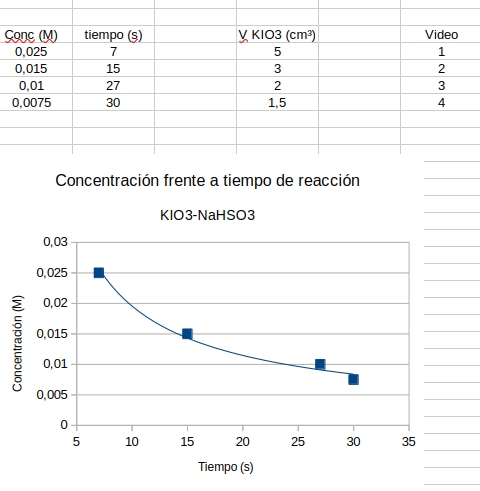 Resultados experimentales cronometrados desde los videos que hay más abajo en esta página. |

